Klordioksit ile ilgili bilgiler
Klordioksit
Klordioksit 1814 yılında Sir Humohrey Davy tarafından keşfedildi.
20. yy başından beri Ostent Belçika da bir spa da kullanılmaya başlanmıştır. Suda çok güçlü bir dezenfektandır. 1950lerde klordan daha az hissedilebildiği için içmesuyu dezenfeksiyonunda daha çok kullanılmıştır.
Bu zamanlarda 700 - 900 kadar içmesuyu tesisinde kullanıldığı bilinmektedir. Günümüzde klordioksit daha çok :
- Temas süresi dezenfeksiyon bakiyesi
- Koku ve tat giderici ön oksidan
- Demir ve mangan kontrolü
- H2S ve fenolik bileşiklerin kontrolünde kullanılmaktadır.
Klordioksit Kimyası
Oksidasyon Potansiyeli
Mikroorganizmaların metabolizması ve kendilerini yenileyebilme özellikleri bulundukları sıvının ( ortamın) ORP de denilen oksidasyon redüksiyon potansiyelinden etkilenmektedir.
Klordioksit klor'un +IV oksidasyon durumundaki nötral bileşiğidir. Oksidasyon yolu ile dezenfeksiyon sağlar, ancak klorlama yapmaz.
Göreceli olarak küçük, uçucu, ve yüksek enerjili bir moleküldür. Seyreltilmiş sulu çözeltide dahi serbest radikal halindedir. Yüksek konsantrasyonlarda indirgeyici maddelerle şiddetli reaksiyona girer. Seyreltilmiş solusyonu kapalı bir tank içinde ve güneş ışığı yokluğunda stabildir. (AWWA 1990)
Klordioksit benzersiz, tek elektron transfer mekanizması ile seçici yüksek oksidan olarak davranır (Klorit ClO2-). Klorit için pKa değeri Ph 1,8 değerinde çok düşüktür. Kloritin, kloröz asidi hipoklorit bazı dengesinin nötral değerlerde olduğunu düşünürsek farklılığını açıkça göstermektedir.
Klorit iyonu bu sayede içmesuyunda baskın türlerle de var olacaktır.
Oksidasyon redüksiyon reaksiyonlarından bazıları aşağıdaki gibidir :(CRC 1990)
ClO2(aq) + e- = ClO2- E° = 0.954V
Diğer önemli yarı reaksiyonlar:
ClO2- + 2H2O +4e- = Cl- + 4OH- E° = 0.76V
ClO3- + 2H2O +2e- = ClO2-+ 2OH- E° = 0.33V
ClO3- + 2H+ +e- = ClO2-+ H2O E° =1.152V
İçmesuyunda Klorit baskın bir son üründür. Klordioksit %50-70 oranında klorite dönüşür ve klorit +30 oranında klorata (ClO3-) ve Klorüre (Cl-)dönüşür.
Klordioksit Üretimi Hakkında
Klordioksitin en önemli fiziksel özelliği suda yüksek oranda çözünebilmesidir, özellikle de soğuk suda. Klor gazının suda hidrolizinin tam tersi klordioksit suda hidrolize olmaz ve solusyonda çözünmüş gaz olarak kalır. Klordan 10 kat daha çözünebilir (11C üzerinde), ancak çok uçucu olduğundan seyreltik sulu çözeltiden çok az bir havalandırma veya CO2 ile karbonizasyon sonucunda hemen uçabilir ( Örn. Yumuşatma sistemleri). 11-12oC üzerinde serbest radikal gaz formunda bulunur. Bu karakteristik özelliği klordioksitin etkisini kesikli solusyon uygulamalarında ve uygun enjeksiyon noktalarına pompalanması durumunda azaltır.
Ayrıca birçok farklı girişim yapan özel bileşiğin suda olması durumunda analizin güçleşmesidir.
Gaz formunda serbest radikallerin su ile tepkimesi çok yavaştır. Reaksiyon hızı klor gazının hidrolizinden 7-10 milyon kat daha yavaştır.
Klordioksit basınç altında tutulamaz ya da gaz klor gibi ticari amaçla depolanamaz. Çünkü basınç altında patlayıcıdır. Bu nedenle taşınamaz, nakledilemez. Klordioksitin havadaki konsantrasyonu hacimce %10 un üzerinde ise patlayıcı olarak nitelendirilir. Patlama sıcaklığı belli basınçlar altında 130oC'dir.
Kuvvetli sulu çözeltilerde klordioksit gazı çözeltiden uçarak atmosfere yayılır. Yeni tip jeneratörlerde sürekli olarak seyreltilmiş gaz formunda klordioksit 100 -300 mm HG basınçta (abs) üretilebilmektedir. İçmesuyu arıtma tesisleri için sulu çözeltinin % 0,1-0,5 arasında kullanımı yaygındır.
Birçok ticari jeneratörde NaClO2 (sodyum klorit) klordioksit üretimi için birincil kimyasal olarak kullanılır. Son zamanlarda klordioksit Sodyum klorattan (NaClO3) üretilebilmektedir. Bu teknolojide sodyum kloratNaClO3, konsantre hidrojen peroksit (H2O2) ve sülfürik asit (H2SO4) karışımı ile indirgenmektedir.
Klorat bazlı sistemler geleneksel olarak kağıt ve kağıt hamuru uygulamalarında kullanılmaktadır. Ancak arıtma tesislerinde uygulaması henüz test edilmemiştir.
Klordioksitin Saflığı
Klordioksit jeneratörleri maksimum üretim verimini sağlamak için çalıştırılırlar, bu sırada serbest klor veya diğer bakiye oksidanların oluşumunu azaltırlar. Spesifik verimleri genel olarak %95'ten büyüktür. Ek olarak ölçülebilir fazla klor değeri ağırlıkça %2 den azdır. Jeneratör verimi aşağıdaki gibi tanımlanmıştır: 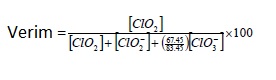
[ClO2] : Klordioksit konsantrasyonu , mg/litre
[ClO2-] : Klorit konsantrasyonu , mg/litre
[ClO3-] : Klorat konsantrasyonu , mg/litre
67,45 : ClO2- moleküler ağırlığı
83,45 : ClO3- moleküler ağırlığı
Klorit iyonu jeneratöre beslenir ise ClO2, ClO2- ya da ClO3- ouşabilir. Bu durumda oluşan karışımın saflığı her bir bileşenin konsantrasyonlarından yola çıkılarak uygun analitik ölçümler sonrasında hesaplanabilir.
Bu hesaplamada debi dahi göz önüne alınmadığından hesaplamalar %5 hata verebilir.
Klordioksiti kullanan işletmeler jeneratör çıkışında hem klorit türevlerini hem de bakiye klor (FAC: Free active chlorine) değerini ölçebilirler.
Eğer rölatif olarak klordioksit seviyesi oluşan karışımda kloritten yüksek ise FAC yanlış klordioksit bakiyesi olarak okunabilir ya da klorlu DBP oluşumuna neden olabilir.
Bakiye klor aşağıdaki gibi tanımlanmıştır :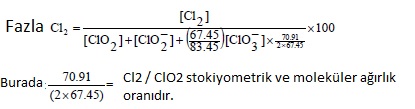
Aşağıdaki denklem özetle daha basit bir eşitliğe göre düzenlenmiştir : 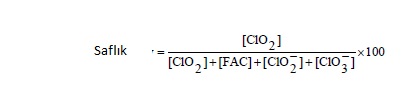
Bu pratik ( ağırlığa göre hazırlanmış) denklem uygulanmış çeşitli analitik metodların sonucudur. Bu hesaplama ile jeneratör performansı tarafsız bilimsel prensiplere göre yapılmış olur.
Klordioksit Üretim Metodları
İçmesuyu uygulamaları için klordioksit sodyum klorit solusyonlarından üretilir.
Burada Klordioksit üretmek için sodyum klorit ile gaz klor, HOCl veya HCl karıştırılarak kullanılır.
Üretim reaksiyonları aşağıdaki gibidir:
2NaClO2 + Cl2(g) = 2ClO2(g) + 2NaCl [1a]
2NaClO2 + HOCl = 2ClO2(g) + NaCl + NaOH [1b]
5NaClO2 + 4HCl = 4ClO2(g) + 5NaCl + 2H2O [1c]
1a, 1b ve 1c deki reaksiyonlarda jeneratörlerin aynı kimyasallar ile ne kadar farklı üretim yaptıkları görülebilir. Bu nedenle bazısı pH kontrolü gerektirirken bazısı düşük pH dan etkilenmez.
Birçok ticari jeneratörde tek bir reaksiyon oluşmaz. Örneğin HOCl ile bazı sıvı klor oluşabilir ve tüm klordioksit üretimini gizleyebilir.
Tabloda bazı ticari jeneratörler ile ilgili bilgi verilmiştir. Konvansiyonel sistemler sodyum klorit ile asit, sıvı klor ya da gaz klor reaksiyonu ile çalışırlar. Elektrokimyasal sistemler ya da katı klorit kullanan sistemler veya klorat tabanlı konsantre hidrojen peroksit ve sülfürik asit kullanan sistemler de bu tabloda gösterilmiştir.
| Jeneratör Tipi | Ana Reaksiyonlar | Özellikler |
| Asit - Klorit |
4HCl + 5NaClO2---> 4ClO2(aq) + ClO3- |
Verim %80 Üretim : Max 25-30 lb/gün |
| Sıvı Klor - Klorit |
Cl2 + H2O ---> [HOCl / HCl] |
NaOH nötralizasyonu için Fazla klor gazı gerekir Max 1000 lb/ gün üretim Verim %80-92 Düşük ph nedeniyle korozif ürün Ph 2,8 -3,5 civarında HCl , NaOCl ve ClO2- için pompa gerekir. Seyreltme suyu ile reaksiyonda birleşir. |
| Geri kazanılmış sulu klor |
2HOCl + 2NaClO2---> 2ClO2 + Cl2 + |
Maksimum verim için konsantrasyonun min 3 gram/litre olması gerekir. Üretim : 1000 lb /gün Verim : %92-98 %10 fazla klor üretimi Pompalar için oldukça korozif, çıkışta kalibrasyon gerekir, olgunlaşma tankına ihtiyaç duyar. |
| Gaz klor - Klorit |
Cl2(g) + NaClO2(aq)---> ClO2(aq) |
Üretim : 5-120000 lb/gün Enjektör ile besleme yapılır Pompa gerekmez Çıkışta pH nötr olur. Verim % 95-99 %2 kadar fazla klor gazı üretimi Debimetre ile yüksek kalitede kalibrasyon. |
| Gaz klor ve katı klorit |
Cl2(g) + NaClO2(s)----> ClO2(g) + NaCl |
Klor gazı azot ile ya da filtrelenmiş hava ile seyreltilerek %8 lik gaz klordioksit akımı oluşturulur. Verim : %99 Üretim : 1200 lb / gün 10 000 lb /gün e çıkarılabilir |
| Elektrokimyasal %25 lik klorit solusyonundan elektroliz ile üretim |
NaClO2(aq) ---> ClO2(aq) + e- |
Soğutma suyu ile gaz klorsioksit karşı akımlar olarak üretim hücresinde karşılaştırılır ve buradan gaz geçirgen membrana püskürtülür. Küçük tek geçişli sistem güç gereksinimleri için kesin akım gerektirir. |
| Asit - peroksit - Klorür |
2NaClO3 + H2O2 + H2SO4 --->2ClO2 + |
Konsantre hidrojen peroksit ve sülfürik asit kullanır. Düşük ph Köpük bağlayıcı Küçük ölçekli |
*Gates 1998
Geleneksel klorür - klorit solusyonu metodu ile klordioksit iki aşamalı proses ile üretilir. Öncelikle klor gazı su ile temas ederek hipokloröz asiti ve hidroklorik asit oluşturur. Bu asitler daha sonra sodyum klorit ile temasederek klordioksiti oluştururlar. Sodyum kloritin oranı hipokloröz asidinin oranı ile dikkatli bir şekilde kontrol edilmelidir. Yetersiz klor beslemesi reaksiyona girmemiş yüksek miktarda klorit üretimi demektir. Sonuçta fazla klor beslemesi olacaktır ve klorat iyonu oluşur. Klorat ise klordioksitin oksidasyon ürünü olduğundan uygulanamaz.
Asit- Klorit Solusyonu : Klordioksit doğrudan asidifikasyon jeneratörleri ile sodyum klorit solusyonunun asitlenmesi ile oluşturulur. Birçok stokiyometrik reaksiyon bu proses için yayınlanmıştır (Gordon). Klordioksit bu yolla üretildiğinden hidroklorit asit genel olarak tercih edilir( 1c reaksiyonu)
Sulu Klor - Klorit Solusyonu : Klorit iyonu (çözünmüş sodyum kloritten) hidroklorit asit ile ve hipokloröz asiti ile reaksiyona girerek klordioksit oluşturur. Geleneksel sistem olarak da bilinir (Reaksiyon 1b)
Aşağıdaki şekilde geleneksel sistemin bir akım şeması vardır : 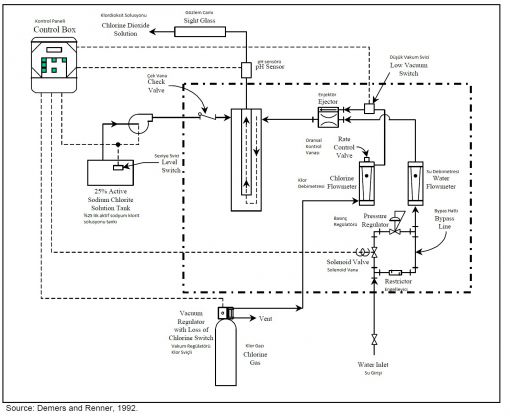
Eğer klor gazı ve klorit iyonu ideal şartlar altında reaksiyona girerlerse ürünün pH değeri 7 ye yakın olacaktır.
Sodyum klorit solusyonunu tamamen kullanmak için, iki bileşenli sistemler daha maliyetli olduğundan, fazla klor genellikle kullanılır.
Bu yaklaşım ph değerini düşürür ve reaksiyonun tam olarak gerçekleşir. Reaksiyon asit - klorit solusyonu metodundan daha hızlıdır ancak diğer metodlardan daha yavaştır.
Geri Dönüştürülmüş Sulu Klor ya da Fransız Çevrimi
Sulu klor dizaynında klor gazı sürekli çevrim halinde olan su hattına enjekte edilir. Bu çok fazla miktarda klor gazının jeneratöre beslenmesini engeller çünkü moleküler klor besleme suyunda çözünecektir. Böylelikle daha düşük pH değeri sağlanacaktır. Çevrim tabanlı jeneratörler kloru doymuş seviyede tutabilir. Düşük pH klordioksitin yüksek verimle üretilmesini sağlar. >%95.
Jeneratör çıkışındaki klor klordioksit ile reaksiyona girebilir, bu durumda klorat oluşur, bu nedenle kesikli depolamanın çok uzun süre yapılmaması istenir.
Fransız çevrimi tipi jeneratörler işletilmesi daha zor olan sistemlerdir. Sodyum kloritin dozaj miktarının , klor dozaj miktarının ve (dozaj pompaları ve debimetreler), sirkülasyon çevriminin (pompa) debisinin kontrol edilmesi gerekir.
Sürekli suyu klor depolama sistemlerinde yeni dizaynlarda ikinci bir depo yer almaktadır. Bu sayede çevrim ve işletme zorluklarının kısmen önüne geçilmiştir.
Gaz klor ve Klorit Solusyonu :
Sodyum klorit solusyonu buharlaşabilir ve vakum altnda moleküler gaz klor ile reaksiyona girebilir.
Bu proses seyreltilmemiş reaktanlar kullanır. KLor solusyonu çözümünden daha hızlıdır. Üretim hızı kolaylıkla boyutlandırılabilir. Bazı kurulmuş sistemlerde 60000 lb/ gün kapasiteden daha çok üretim yapılabilmektedir.
Klor gazı mümkün değil ise asit - sodyum hipoklorit - sodyum klorit metodu ile klordioksit üretilebilir.
Öncelikle sodyum klorit hidroklorik asit ya da diğer asit ile birleştirilerek hipokloröz asit oluşturulur. Sonra sodyum klorit reaksiyona eklenir ve klordioksit üretilir.
Klordioksit Üretiminde pH 'ın Etkisi
Hipokloröz asiti oluşmuş ise sodyum klorit ile reaksiyonundan yan ürün olarak sodyum hidroksit (NaOH) oluşacaktır. Sodyum hidroksit sodyum klorit için stabilizatör olduğundan pH değeri yükselecektir. Yüksek pH klordioksit oluşumunu yavaşlatacak ve verimsiz bir üretime neden olacaktır.
Bu içmesuyunda klorit ve hipoklorit iyonlarının reaksiyonu ile klorat oluşmasına benzer bir prosestir.
Klor solusyonlarının çok düşük pH değerlerinde kloröz asidi doğrudan klordioksite okside olabilir.
2HClO2 + HOCl = HCl + H2O + 2ClO2 [1d ]
Düşük pH değerinde gaz klor suda normalden daha yüksek konsantrasyonda çözünmüş olarak kalır ve 1a denkleminin oluşmasına izin verir.
Klorat Yan Ürününün Oluşması
İstenmeyen yan ürünlerden klorat üretim reaksiyonlarının ara kademesinde oluşabilir.
Kolaylıkla klorsioksite dönüştürülebilen Klorit iyonundan ziyade 1a 'dan 1d ye kadar olan reaksiyonlar stabil ve simetrik olmayan Cl2O2 veya Cl-ClO2 oluşumuna neden olurlar.
Cl2 + ClO2- = {Cl-ClO2} + Cl-
Bazı jeneratörlerde düşük konsantrasyonda reaktanlar ile çalışılır. Bu durumda belirgin miktarda klorat aşağıdaki reaksiyonlar ile oluşur.
{Cl2O2} + H2O = ClO3- + Cl- + 2H+ [3a]
{Cl2O2} + HOCl = ClO3- + Cl- + H+ [3b]
{Cl2O2} + 3HOCl + H2O = 2ClO3- + 5H+ + 3Cl- [3c]
Asitliği yüksek ph < 3 olan reaksiyon karışımlarında Cl2O2 klorata indirgenme durumu yaşanır. Aynı şekilde klorit de klorata oksitlenebilir.
Klorat iyonu oluşumunu gösteren bütün reaksiyon aşağıda belirtilmiştir:
ClO2- + HOCl = ClO3- + Cl- + H+ [4a]
ve
ClO2- + Cl2 + H2O = ClO3- + 2Cl- + H+ [4b]
Aşağıdaki şartlarda da klorat üretimi yaşanabilir:
- Klor gazı / Klorit oranının aşırı yüksek oranda olması durumunda
- Yüksek konsantrasyonda serbest klorun düşük pH değerinde sulu çözeltide bulunması durumunda
- Seyreltik klorit solusyonlarının düşük pH değerinde tutulması durumunda
- Baz katalizörlü orantısız klordioksitin yüksek pH değerinde tutulması durumunda (ph > 11 )
- Reaksiyon karışımının yüksek derecede asidik olması durumunda (ph< 3 )
- Fazla hipokloröz asidinin klorit iyonlarını okside etmesi ile klorat iyonlarının
oluşması durumunda.
Jeneratör Dizaynı
Hipokloröz asit asidik şartlar altında üretilir ise 3b reaksiyonuna göre klorat iyonu seviyesi jeneratörde artacaktır.
Bu nedenle jeneratörde zayıf bir asit ya da yüksek miktarda seyreltme suyu kullanılırsa 3a reaksiyonuna göre klorat daha yaygın olacaktır.
Bu kısıtlar nedeni ile jeneratörde %25 lik klorit solusyonu ya da gaz klor kullanıldığını açıklayabiliriz.
Sodyum kloritin yüksek kuvvetli solusyonları (%37) kristalize olmaya yatkındır ve ortam sıcaklığında (25-27C) katmanlara ayrılabilir.
Bu etkiler nedeni ile bazı sistemlerde en iyi kesikli şekilde üretim yapılabilir.
Bu sistemler ile daha yüksek konsantrasyonda klordioksit üretilir. Sürekli üretim yapan jeneratörlerde düşük konsantrasyonda üretim yapılabilir (< 1 gram/litre)
Depolanmış solusyonlar depo tankından pompa ile ya da enjektör ile uygulama noktasına iletilir.
24 saatin üzerindeki depolama söz konusu olduğunda çevrim yapmak gereklidir.
Eğer fazla klor sürekli mevcut ise klor çevrimi tipi sistemlerde yüksek dönüşüm oranları görülebilir.
Fazla klor molelüker klor reaksiyon mekanizmasını işletir.
Karışımın düşük pH değerinde olması nedeni ile 1b denklemi ile hidroksil üretimi görülür.
Bu solusyonlar halen fazla klor ile kontamine olduğundan, seyreltilmiş solusyonda bulunduğundan başka derecede bir klorit iyonuna dönüştürülmesi gereklidir. Klor çevrimi jeneratörleri yüksek kapasitede üretim gerektiğinde daha iyi bir alternatiftir.
**
Klordioksitin Kullanım Alanları
Klordioksit doğası gereği uçucu gaz olduğundan piston akış sistemlerinde daha iyi çalışır. Borulama sistemleri bunlara örnektir. Seyreltilmiş sulu çözeltiden türbülans havalandırma ile kolaylıkla ayrışır. Örneğin hızlı karıştırma tankları.
Filtrelenmiş suda hiçbir bakiye bırakmaz.
Son dezenfeksiyon yerine kullanıldıında temiz kuyularda ya da transfer (dağıtım) hatlarında kullanılabilir.
Numune noktalarından bakiye konsantrasyonları izlenebilir.
Klordioksit UV ile giderilebilir. Bu nedenle güneş ışığı veya parlak florasan ışığı klordioksitin uçmasına neden olacaktır. Bu tür etkilerden depolandığı ya da dozlandığı alanda korunması gereklidir.
Klordioksit ile Dezenfeksiyon
Birincil dezenfektan olarak klordioksit seçilmeden önce suyun oksitlenebilirliği araştırılmalıdır. Bu çalışma mevsimsel olarak yapılmalı ve uygulama noktasındaki su kalitesi ve sıcaklık değişimi izlenmelidir.
Aşağıdaki tabloda yüzeysel su kaynağından alınmış tek bir numunenin ihtiyacı araştırılmıştır :
Yüzeysel Sularda Dezenfeksiyon için Yeterli Olan Klordioksit Dozaj Miktarları Örneği :
Dozaj : 1,4 mg/ litre
| Zaman Dakika |
Klordioksit mg/litre |
Klorit mg/litre |
Klorat mg/litre |
| 3 | 0,47 | 0,76 | 0,05 |
| 10 | 0,30 | 0,98 | 0,06 |
| 20 | 0,23 | 1,08 | 0,07 |
| 40 | 0,16 | 1,11 | 0,07 |
| 60 | 0,11 | 1,11 | 0,07 |
-DeMers and Renner
Klordioksitin maksimum bakiye dezenfektan seviyesi 0,8 mg/litredir.
Maksimum kirletici seviyesi 1 mg/ litredir.
Eğer oksitlenebilirlik seviyesi 1,4 mg/ litre civarında ise klordioksit bu uygulamada dezenfektan olarak kullanılamaz, çünkü klorit / klorat oranı ile yan ürün oluşumu sebebi ile maksimum izin verilen seviye aşılacaktır.
Geleneksel su tesislerinde oluşabilecek fazla klorit seviyesini gidermek için birçok yöntem klorlamadan önce uygulanabilir.
İçmesuyu arıtımında dezenfektan olarak kullanılırsa klordioksit dozaj değerleri 0,07 -2 mg/ litre arasında değişmektedir.
Klordioksit kullanan işletmelerde klorit ve klorat ortalama konsantrasyonları 0,24 - 0,2 mg/ litre olarak tespit edilmiştir. EPA Standartı 1 mg/ litredir.
Klordioksit ile Tat ve Koku Kontrolü
Klordioksit tat ve koku oluşturan fenollü bileşikleri giderebilir.
Uygulama noktası suyun kalitesine, arıtma tesisinin tipine, diğer amaçlarla klordioksit eklenip eklenmeyeceğine göre değişir.
Geleneksel arıtma tesislerinde klordioksitin çöktürmenin sonuna ya da çöktürme tankından hemen sonra uygulanması önerilir.
Eğer ham suyun bulanıklık değeri ( < 10 NTU) düşük ise klordioksit tesis girişinde eklenebilir.
Bazı tesisler bu şekilde uygulama yapmaktadırlar çünkü klordioksit alg büyümesini engeller. Böylece flokülasyon ve çöktürme haznesinde güneş ışığı ile artan alg büyümesinin önüne geçilir.
Böyle bir uygulamanın karanlık zamanlarda yapılması daha başarılı sonuçlar elde edilmesini sağlayacaktır.
Klordioksit ile Demir ve Mangan Oksidasyonu
Klordioksit demir ve manganın oksidasyonunda kullanılabilir. Demir ve manganın suda çözünmüş halleri ile reaksiyona giren klordioksit bu maddelerin çöktürülebilir formlarına oksitlenmesini sağlar ve çöktürme ve filtrasyon ile sudan giderilmeleri kolaylaşır.
Klordioksit bu reaksiyonda klorit itonunu da azaltır.
1,2 mg/litre klordioksit dozajı ile 1 mg/ litre demir ve
2,5 mg/ litre klordioksit dozajı ile 1 mg/ litre mangan giderimi yapılabilir.
Suda yüksek konsantrasyonlarda demir ve mangan içeriği var ise yan ürün üretilmemesi için ancak 1 mg/ litre klorit / klorat oranına kadar klordioksit kullanılabilir. Böyle bir durumda suya klordioksit eklenmeden önce Klorit iyonunu klorür iyonuna çevirmek için koagülasyondan önce FeCl2 eklenebilir.
Klordioksit ile Patojen İnaktivasyonu ve Dezenfeksiyon Verimi
Su arıtmada klordioksitin klora göre çeşitli avantajları vardır.
Klordioksit doğal suların tipik pH değerlerinde sürekli olarak moleküler formda kalır.
Güçlü bir oksidandır ve dezenfektandır.
Dezenfeksiyon mekanizması tam olarak anlaşılamamakla beraber mikroorganizmaların birçoğuna uygulanabilir.
İnaktivasyon Mekanizması
İçmesuyu dezenfeksiyonu sırasında bakteri hücrelerine veya virüslere fiziksel hasar verme etkisi düşük konsantrasyonlarda gözlemlenmemiştir.
Bu nedenle bakterileri inaktive etme durumu ve fizyolojik fonksiyonlarına etkisi incelenmiştir.
1983 ve 1985 de yapılan araştırmalarda klordioksitin sistein, triptofan, tirozin aminoasitleri ile reaksiyona girdiği ancak RNA ile reaksiyona girmediği tespit edildi ve klordioksitin viruslerin proteinleri imha ederek onları inaktive ettiğine karar verildi. Ancak 1982 de yapılan başka bir araştırmada klordioksitin polivirüslerin RNA'sı ile reaksiyona girdiği ve RNA sentezini durdurduğu bulunmuştu. 1983 de yapılan bir araştırmaya göre ise serbest yağ asitleri ile de reaksiyona girebiliyordu.
İkinci tip dezenfeksiyon mekanizmasında klordioksitin fizyolojik fonksiyonlara etkisine bakıldı. Protein sentezinin bozulduğu belirlendi. Bundan sonra yapılan araştırmalarda birincil inaktivasyon mekanizmasının protein sentezini engelleyici işlev olmadığ belirlendi. 1985 de yapılan bir başka araştırma klordioksitin hücre membranının geçirgenliğini bozduğu belirlendi. Olivieri'nin çalışmalarına göre klordioksit dış membrandaki protein ve yağları değiştiriyor ve geçirgenliği arttırıyordu.
Çevresel Etki
Ortamda pH, sıcaklık, askıda madde olması durumunda dezenfeksiyon performansının ve bakteri inaktivasyonunun değişimi :
Klordioksit Dezenfeksiyonunda pH 'ın Etkisi
Klordan farklı ph 6- 8,5 arasında uygulanan dezenfeksiyon işleminde klordioksit ile patojen inaktivasyonunda pH'ın etkisi oldukça düşüktür.
Poliovirus 1 ve Naegleria gruberi cysts üzerinde yapılan araştırmalar göstermiştir ki pH arttıkça patojenlerin inaktivasyonu artmaktadır.
E.Coli üzerinde yapılan araştırmalar henüz yetersizdir.
Bernarde'nin çalışmasında ph arttıkça inaktivasyon verimi arttığı görülürken,
Ridenour'un araştırmasında pH 6-10 arasında bakteri aktivitesinin değişmediği belirlenmiştir.
Cryptosporidium üzerinde yapılan araştırmalarda Le Chevallier, ph 8 değerinde inaktivasyonun ph 6 dakine oranla daha hızlı olduğu ve iki katı olduğunu belirlemiştir.
Giardia üzerinde yapılan bir araştırmada Liyanage, yüksek pH değerlerinde inaktivasyonun arttığını belirlemiştir.
pH 'ın inaktivasyon üzerindeki etkisi için daha çok araştırma gerekmektedir.
Sıcaklık
Klora benzer olarak klordioksit ile dezenfeksiyon verimi sıcaklık düştükçe artmaktadır.
LeChevallier'in yaptığı bir araştırmada sıcaklığın 20C den 10C 'a indirilmesi dezenfeksiyon verimini Cryptosporidium üzerinde %40 arttırmıştır.
Gregory 'nin bir araştırmasında ph 8,5 değerinde 2 log giderim için 3 mg/ litre dozaj ve 60 dakika bekleme süresi gerekmiştir.
Nötral ph değerinde sıcaklık düşürülse dahi 20 mg/ litreden çok dozaja ihtiyaç olmuştur.
Askıda Madde
İnaktivasyon söz konusu olduğunda askıda madde ardına saklanan patojenler klordioksitin dezenfeksiyon performansını etkilemektedir.
**
Klordioksit Kullanımının Avantaj ve Dezavantajları
AVANTAJLAR
- Klordioksit virus, cryptosporidium ve giardia inaktivasyonunda klor ve kloraminlerden daha etkilidir.
- Demir, mangan ve sülfitleri oksitler
- Çöktürme prosesini hızlandırır
- Alg giderimini sağlayarak Tat ve koku giderimi sağlar
- Fenollü bileşikleri oksitler
- Fazla klor bulunmayan durumlarda halojenli bileşikler DBP (dibromophenol) oluşmaz
- Üretimi kolaydır
- Biosidal özellikleri pH değerinden etkilenmez
- Bakiye bırakabilir
DEZAVANTAJLARI
- Klorit ve klorat yan ürünleri oluşturabilir
- Jeneratör verimi ve optmizasyonundaki zorluklar fazla klor üretimine neden olur ve bu nedenle halojenli DBP oluşur.
- Klorit ve klorat oluşması durumunda maliyeti(eğitim, numune alma ve laboratuvar tesleri ile) yükselir
- Ekipmanlar kiralanabilir, sodyum klorit fiyatları yüksektir.
- Klordioksit gazı patlayıcıdır bu nedenle yerinde üretilmelidir.
- Güneş ışığı altında bozunur.
- Sahada üretilmesi gerekir.
- Bazı proseslerde tehlikeli kokular oluşturabilir.






